زنگ آهن نامی متداول برای ترکیب علمی اکسید آهن با فرمول شیمیایی Fe2O3 است. آهن بسیار راحت با اکسیژن ترکیب می شود، در واقع آهن خالص به ندرت در طبیعت یافت می شود زیرا به سرعت با اکسیژن موجود در هوا واکنش می دهد. فرآیند زنگ زدن آهن را می توان در اکثر سازه های آهنی که در معرض آب و هوا قرار دارند مشاهده نمود، با استفاده از حلال زنگ آهن در مراحل اولیه می توان از تخریب فلزات جلوگیری کرد. در ادامه به بررسی این فرآیند، روش های جلوگیری از خوردگی و در نهایت حلال های رایج برای از بین بردن زنگ آهن را بررسی خواهیم نمود.
زنگ زدن آهن (یا فولاد) یک نمونه از خوردگی فلزات است. خوردگی اصطلاح کلی است که نشان دهنده تبدیل فلز به ترکیبات محلول می باشد. خوردگی می تواند منجربه اختلالاتی در بخش های بحرانی و مهم سیستم های دیگ بخار و رسوب فرآورده های خوردگی در سیستم انتقال حرارت و کاهش کارایی کلی شود.
واکنش خوردگی یک فرآیند الکتروشیمیایی بوده و سه جزء اساسی دارد:
آند: قطعه ای از فلز که به راحتی الکترون ها را از دست می دهد
الکترولیت: مایع که به حرکت الکترون ها کمک می کند
کاتد: قطعه ای از فلز که به راحتی الکترون ها را قبول می کند
فهرست مطالب
فرایند تشکیل زنگ آهن چگونه است؟
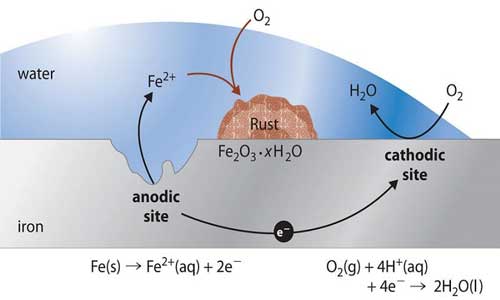
هنگامی که یک قطعه از فلز دچار خوردگی می شود، الکترولیت به رسیدن اکسیژن به آند کمک می کند. در نتیجه وقتی اکسیژن با فلز ترکیب می شود، الکترون ها آزاد می شوند و آنها از طریق الکترولیت به کاتد جریان می یابند فلز آندی از بین می رود و یا تبدیل به کاتیون فلزی می شود. برای اینکه آهن تبدیل به اکسید آهن شود، سه چیز مورد نیاز است: آهن، آب و اکسیژن.
وقتی که یک قطره آب به یک قطعه از آهن می رسد بلافاصله دو اتفاق شروع به رخ دادن می کند:
- آب به الکترولیت خوبی تبدیل می شود و با کربن دی اکسید هوا ترکیب می شود و کربنیک اسید رقیقی را تشکیل می دهند که یک الکترولیت به مراتب بهتری محسوب می شود.
- با تشکیل شدن اسید و مصرف شدن آهن قسمتی از آب شروع به تجزیه شدن می نماید و به اکسیژن و هیدروژن تبدیل می گردد. در این فرآیند (آزاد شدن الکترون ها) اکسیژن های آزاد شده و عناصر آهن حل شده با یکدیگر ترکیب شده و پیوند اکسید آهن را تشکیل می دهند و زنگ زدن آهن را پدید می آورند.
واکنش زنگ زدن آهن
هنگامی که یک قطره آب حاوی یک اکسیژن بر روی یک قطعه فولادی می افتد، آهن جامد یا یون آهن (Fe) در سطح تماس قطره، فرآیند اکسید شدن زیر در آن اتفاق می افتد:
Fe(s) → Fe2+ (aq) + 2e–
الکترون ها به سرعت توسط یون های هیدروژن از آب (H2O) و اکسیژن محلول در لبه قطره و مرز تماس آن برای تولید آب مصرف می شوند:
(4e– + 4H+ (aq) + O2 (aq) → 2H2O (l
آب اسیدی بیشتر خوردگی را افزایش می دهد. اگر pH خیلی پایین باشد، یون های هیدروژن به هر حال الکترون ها را مصرف می کنند و به جای آب تولید گاز هیدروژن می کنند:
(2H+ (aq) + 2e– → H2 (g
اما زنگ زدگی کجا اتفاق می افتد؟ معادلات بالا فقط بخش کوچکی از این فرآیند را بیان می کند. یون های هیدروژن از طریق این فرآیند مصرف می شوند. به دلیل خورندگی آهن، pH در قطره ها افزایش می یابد.
یون های هیدروکسید (OH-) غلظت یون هیدروژن در آب را بالا می برند. آنها با یون آهن (II) واکنش دهند تا هیدروکسید آهن (II) نامحلول یا زنگ سبز تولید کنند:
(Fe2+ (aq) + 2OH–(aq) → Fe (OH) 2(s) (1
یونهای آهن (II) همچنین با یونهای هیدروژن و اکسیژن واکنش میدهند تا یونهای آهن (III) تولید کنند:
(4Fe2+ (aq) + 4H+ (aq) + O2 (aq) → 4Fe3+ (aq) + 2H2O (l
یون آهن (III) با هیدروکسید واکنش می دهد تا اکسید هیدراته آهن (III) به عنوان هیدروکسید آهن (III) شناخته شود را تولید کند:
Fe3+ (aq) + 3OH–(aq) → Fe (OH) 3(s) (2)
هیدروکسیدهای تولید شده در مراحل (1) و (2) در نهایت دیهیدراته شده و Fe2O3 یا همان اکسید آهن تشکیل می شود.
روش های جلوگیری از خوردگی فلزات
برای جلوگیری از خوردگی ها از ترکیبات شیمیایی استفاده می شود که با سطح فلزی یا محیطی که فلز در آن قرار گرفته واکنش می دهند تا سطح را در برابر خوردگی تا حدود مشخصی محافظت کنند. در واقع این مواد شیمیایی زمانیکه به آب یا هر محلول دیگری اضافه می شوند سرعت خورده شدن سطح فلز را کاهش می دهند. مهارکننده ها اغلب با جذب خود بروی سطح فلز،و با تشکیل یک فیلم روی سطح فلز از آن در برابر خوردگی محافظت می کنند.
ضد خوردگی ها به طور معمول به آندیک، کاتدیک، تشکیل فیلم، و عامل جذب کننده اکسیژن تقسیم بندی می شوند وبسته به نوعشان فعالیت می کنند.
اثر بخشی اغلب ضد خورده ها به طور قابل ملاحظه ای تحت تاثیر خواص شیمیایی (کیفیت) آب، ترکیب مایع، شرایط فیزیکی مانند دما و سرعت جریان قرار دارد. برخی از مکانیزم های اثر ضد خورده ها تشکیل یک لایه یک فیلم نازک روی سطح فلز یا آلیاژ است که دسترسی مواد خورنده را به فلز محدود می کند.
از ترکیبات شیمیایی که خاصیت ضد خوردگی دارند می توان به هگزامین هگزا متیلن تترا آمین C6H12N4، فنیلن دی آمین ،دی متیل اتانول آمین ،نیتریت سدیم ،ترکییبات کروم مثل کرومات سدیم ،فسفات ها،هیدرازین ،آسکوربیک اسید و .. اشاره کرد. انتخاب یک ماده مناسب برای این عمل به بسیاری از عوامل از مواد و ترکیبات موجود در سیستم تا ماهیت خود ماده ای که به سیستم اضافه می شود و همچنین دمای سیستم بستگی دارد .
مهار کننده های خوردگی آندی :
این مهار کننده ها یک فیلم محافظ روی سطح آند(جایی که در آن اکسایش رخ می دهد) تشکیل می دهند. در اینصورت از انجام واکنش الکتروشیمیایی در سطح فلز که باعث حل شدن فلز می شود جلوگیری می شود.
مهارکننده های آندی برای آهن به دو گروه اکسنده و غیر اکسنده تقسیم بندی می شوند.
موادی که به عنوان یک اکسنده ضد خوردگی آندیک شناخته می شود:
- کرومات ها (CrO42-) : کرومات سدیم
- نیتریت ها (NO2-) : نیتریت سدیم
کرومات ها به عنوان یک ماده شیمیایی ضد خوردگی آندی ،یک لایه روی سطح آلومینیوم(Al) و استیل تشکیل می دهد بدین ترتیب از اکسیداسیون فلز جلوگیری می کند. نیتریت سدیم یکی دیگر از ضد خوردگی های آندی می باشد. این ترکیبات در غلظت های خیلی کم استفاده می شوند.
موادی که به عنوان یک غیر اکسنده ضد خوردگی آندی شناخته می شود:
- فسفات ها(PO43– ): تری سدیم فسفات
- بنزوات ها(C7H5O2– ) : بنزو تیازول
- مولیبدات ها (MoO42-)
مهار کننده های ضد خوردگی از نوع کاتدی:
این مواد با کاهش دادن اکسیژن یون هیدروکسید (OH-) تولید می کنند. مهار کننده های کاتدی در آب با pH خنثی محلول هستند، اما در pH بالا (قلیایی) یک لایه محافظ روی سطح کاتد با تشکیل یک ترکیب نامحلول که هادی الکتریکی هم نیست.
- یون روی (زینک) Zn 2+
- ترکیبات پلی فسفات (همراه با یون کلسیم Ca2+)
- فسفونات ها : شامل HEDP-PBTC –ATMP
زینک اکساید(ZnO) مثالی برای مهار کننده های کاتدی است که خوردگی را با مهار کردن کاهش(احیا) آب به گاز هیدروژن کاهش می دهد.
مهار کننده های ترکیبی اندی و کاتدی :
از ترکیب ضد خوردگی های اندی و کاتدی بدست می آید.
- ترکیب فسفات ها با زینک،
- فسفوناتها با زینک،
- فسفات ها با پلی فسفات ها،
- فسفات ها با فسفونات ها
روش های جلوگیری از زنگ زدن آهن
آلیاژ کردن
از آنجا که زنگ زنگ آهن یک فرایند شیمیایی است که به این دلیل اتفاق می افتد که فلز به حالت شیمیایی پایدار تر می رسد، آلیاژ (مخلوط کردن) آهن با سایر فلزات پایدار یا آلیاژ ها می تواند روند این فرایند غیر مفید را کاهش دهد.
گالوانیزه کردن
گالوانیزه فرایندی است که سال هاست برای محافظت از فولاد زنگ نزن استفاده می شود. در فرآیند گالوانیزه یک قطعه فولاد با روی مایع پوشش داده می شود. روی از فولاد به سه روش مختلف محافظت می کند. اول، پوشش روی به عنوان یک مانع از دسترسی اکسیژن و آب به فولاد عمل می کند. دوم، حتی اگر پوشش خراشیده شود، روی به حفاظت از کاتد کمک می کند تا از مناطق مرزی تماس با فلز محافظت کند. و سوم، زینک نسبت به اکسیژن بسیار واکنش نشان می دهد و به سرعت یک پوشش محافظ اکسید روی را ایجاد می کند که آهن را از اکسیداسیون بیشتری جلوگیری می کند.
پوشش دهی و نقاشی
پوشش سطح یک شیء فلزی با یک لایه از رنگ یا وارنیش، تماس بین سطح اکسیژن و اتمسفر را از بین می برد و در نتیجه زنگ زدن آن را به تعویق می اندازد. رنگ آمیزی با حذف آب، الکترولیت ها و هوا از فلزات آهنی از زنگ جلوگیری می کند.
کنترل رطوبت
آب، وقتی به یک فلز می رسد دشمن شماره یک آن است، زیرا اکسیژن موجود در مولکول های آب است که با آهن ترکیب می شود تا اکسید آهن تولید شود. به همین دلیل است که فلزات خارج از منزل، مانند خودروها، درها یا مخازن نگهداری دچار این مشکل می شوند. اگر جسم در محيطی مرطوب مانند گاراژ يا زيرزمين قرار گيرد، حتما یک رطوبت گیر را در ان محل قرار دهید. هر نوع گل یا خاکی که در سطح اشیا قرار دارد، می تواند آب و رطوبت را حفظ کند، بنابراین مهم است که فلزات تمیز شوند.
حفاظت کاتدی
در این روش و توسط یک جریان الکتریکی و قرار دادن یک فلز قربانی شونده از خوردگی فلزات جلوگیری می شود. حفاظت کاتدی برای خطوط لوله چه در خشکی و چه در دریا بسیار مورد استفاده قرار می گیرد.
حلال زنگ آهن
شستشوی زنگ آهن از سطح فلزات به فرآیند اسید شویی موسوم است که در آن فلز بوسیله یک اسید معدنی شستشو می شود.در طی تماس این اسید معدنی با اکسید آهن یک کمپلکس تولید می شود که عوامل اکسید شونده را در خود حل کرده و بعد از آن می تواند بوسیله آب شستشو داده شود.اسید هایی همچون نیتریک اسید، اسید فسفریک، سولفوریک اسید و… برخی از حلال هایی هستند که می توان از آنها برای حل کردن زنگ آهن استفاده نمود. همچنین برای این کار در محیط های خانگی می توان از آب لیمو (اسید سیتریک) و سرکه (اسید استیک) بهره گیری کرد.
واکنش آهن با سولفوریک اسید
آهن طی واکنش جابجایی، هیدروژن را از اسید سولفوریک جابجا کرده و به FeSO4 تبدیل می شود.
واکنش جابجایی هیدروژن اسید سولفوریک توسط آهن به شرح زیر است.
Fe + H2So4 → FeSo4 + H2





