شیمی کوانتوم یک ابزار بسیار قدرتمند برای مطالعه خواص مولکول ها و واکنش آن ها است. این مبحث یکی از پویاترین زمینه های شیمی معاصر است که پایه ای محکم برای تمام زمینه های شیمی فراهم می کند. در اواخر قرن هفدهم ، آیزاک نیوتن، بر مبنای مکانیک کلاسیک، قوانین حرکت اجرام ماکروسکوپی را کشف کرد.
در اوایل قرن بیستم، فیزیکدانان دریافتند که مکانیک کلاسیک رفتار ذرات بسیار کوچک مانند الکترون ها و هسته های اتم ها و مولکول ها را به درستی توصیف نمی کند. رفتار چنین ذراتی با مجموعه قوانینی به نام مکانیک کوانتوم توصیف می شود. شیمی کوانتوم، مکانیک کوانتوم را در مسائل شیمی اعمال می کند و تاثیر آن در تمام شاخه های شیمی مشهود است.
فهرست مطالب
تاریخچه شیمی کوانتوم
توسعه مکانیک کوانتومی در سال 1900 با مطالعات پلانک در مورد نشر نور به وسیله اجسام گرم شده گسترش یافت. در این بخش به طور مفصل از آغاز شروع به بررسی چگونگی پیدایش این مفهوم مهم می پردازیم.
ماهیت ذره ای نور
در سال 1803 توماس یانگ مدارک قابل قبولی را برای ماهیت موجی نور با مشاهده تفرق و تداخل نور در هنگام عبور نور از دو سوراخ مجاور را ارائه داد. در سال 1864 ماکسول، چهار معادله را، که با معادلات ماکسول شناخته می شوند، معرفی کرد که قوانین الکتریسیته و مغناطیسیته را به هم مربوط می کرد. معادلات ماکسول پیش بینی کرد که یک بار الکتریکی شتاب دار انرژی را به شکل امواج الکترومغناطیسی متشکل از نوسانات میدان های الکتریکی و مغناطیسی تابش می کند. سرعت پیش بینی شده توسط معادلات ماکسول برای این امواج معلوم شد همان سرعت اندازه گیری آزمایشی نور است. ماکسول نتیجه گرفت که نور یک موج الکترومغناطیسی است.
در سال 1888، هانریش هرتز، نشان داد، طبق معادلات ماکسول، که امواج رادیویی با مشارکت بارهای الکتریکی در یک جرقه تولید می شوند. این موضوع فیزیکدانان را متقاعد کرد که نور در واقع یک موج الکترومغناطیسی است.
تمام امواج الکترومغناطیس با سرعت 108 × 2.998 متر بر ثانیه حرکت می کنند. معادله اندازه گیری سرعت نور به صورت زیر است که در آن λ طول موج و ν فرکانس امواج الکترومغناطیس است.
c = λν
محاسبه انرژی جسم
در دهه 1890 ، فیزیکدانان شدت نور را در فرکانس های مختلف ساطع شده توسط یک جسم سیاه گرم شده در دمای ثابت اندازه گیری کردند و این اندازه گیری ها را در چندین دما انجام دادند. جسم سیاه وسیله ای است که تمام نور ها را جذب می کند. در سال 1896، وین معادله ای برای وابستگی تابش جسم سیاه به مقدار فراوانی نور و دمای جسم سیاه پیشنهاد کرد:
I = aν3 / e bv / T
در این معادله، a و b ثابت تجربی هستند، و I انرژی با فرکانسی در گستره ν تا + dνν در واحد زمان و سطح جسم سیاه می باشد. معادله وین با اطلاعات به دست آمده از تشعشعات جسم سیاه در سال 1896 مطابقت داشت اما استدلال های نظری او برای فرمول نامطلوب بود.
مفهوم کوانتیزه بودن (کمی بودن) انرژی
در سالهای 1899–1900 ، اندازه گیری تشعشعات جسم سیاه به فرکانس های پایین تر از اندازه گیری قبلی افزایش یافت و داده های با فرکانس پایین انحراف قابل توجهی از فرمول وین نشان داد. این انحرافات باعث شد كه ماكس پلانك، فرمول زیر را در اكتبر 1900 پیشنهاد كند، كه مطابقت بسیار خوبی با داده ها در همه فركانس ها داشت.
I = aν 3/ (e bν / T -1)
پلانک که با ارائه این فرمول، به دنبال توجیه نظری آن بود، در دسامبر 1900، یک معادله تئوری را به جامعه علمی آلمان ارائه داد. پلانك فرض كرد كه ساطع كننده ها و جاذب هاي تشعشع در جسم سياه به طور هماهنگ بارهاي الكتريكي نوسان دهنده در تعادل با تشعشع شبكه الكترومغناطيس در حفره هستند. وی فرض کرد که کل انرژی تشدیدکننده هایی که فرکانس آنها ν است از “عناصر انرژی” غیر قابل تقسیم تشکیل شده، که این عناصر یک عدد صحیح هستند و h (ثابت پلانک) یک ثابت جدید در فیزیک است. بنابراین انرژی را به صورت کوانتیزه در نظر گرفته و فقط مقادیر خاصی برای یک انرژی تشدید کننده مجاز بود. نظریه پلانک نشان داد که a = 2πh/c2 و b = h/k که در آن k ثابت بولتزمن است و h = 6.6 ×10-34 J.s است.
مفهوم کوانتیزه سازی انرژی با تمام ایده های قبلی فیزیک در تناقض مستقیم است. طبق مکانیک نیوتنی، انرژی یک جسم ماده می تواند به طور مداوم تغییر کند. با این حال، تنها با فرضیه انرژی کوانتیزه می توان منحنی های صحیح تابش جسم سیاه را بدست آورد. دومین کاربرد کمی سازی انرژی ، اثر فوتوالکتریک بود. در اثر فوتوالکتریک، تابش نور به یک فلز باعث انتشار الکترون می شود.
استفاده از مفهوم کوانتیزه در رفتارذرات زیر اتمی
انرژی یک موج متناسب با شدت آن است و به فرکانس آن ارتباط ندارد ، بنابراین تصویر موج الکترومغناطیسی از نور باعث می شود فرد انتظار داشته باشد که با افزایش شدت نور، انرژی جنبشی یک فوتوالکترون ساطع شده افزایش یابد، اما تغییری نمی کند و فقط فرکانس نور تغییر می کند. در عوض، مشاهده می شود که انرژی جنبشی الکترون ساطع شده از شدت نور مستقل است و فقط با افزایش فرکانس نور افزایش می یابد.
در سال 1905 ، اینشتین نشان داد که این مشاهدات را می توان، با توجه به اینکه نور از ذره تشکیل شده است، (فوتون نامیده می شود) توضیح داد، و هر فوتون دارای انرژی است.
E photon = hν
زمانیکه الکترون یک فلز فوتون جذب می کند، بخشی از انرژی فوتون جذب شده برای غلبه بر نیروهای الکترون در فلز استفاده می شود و باقیمانده آن به عنوان انرژی سینتیکی الکترون بعد از ترک فلز ظاهر می شود. انرژی مصرف شده با معادله hν= Ф + T که در آن Ф کمترین میزان انرژی لازم برای جدا شدن یک الکترون از فلز و T بیشترین انرژی سینتیکی الکترون منتشر شده است. افزایش فرکانس نور منجر به افزایش انرژی فوتون و در نتیجه افزایش انرژی سینتیکی می شود. افزایش شدت فرکانس منجر به افزایش سرعت انتشار الکترون از فلز می شود اما انرژی سینتیکی الکترون منتشر شده را تغییر نمی دهد. در سال 1907 انیشتین با فرض اینکه انرژی ارتعاشی هر اتم در هر جهت به یک عدد صحیح hν محدود می شود، مقدار انرژی را برای ارتعاشات اتم ها در یک عنصر جامد اعمال کرد.
بیشتر بخوانید: تبدیل مالئیک اسید به فوماریک اسید
شیمی کوانتوم در ذرات زیراتمی
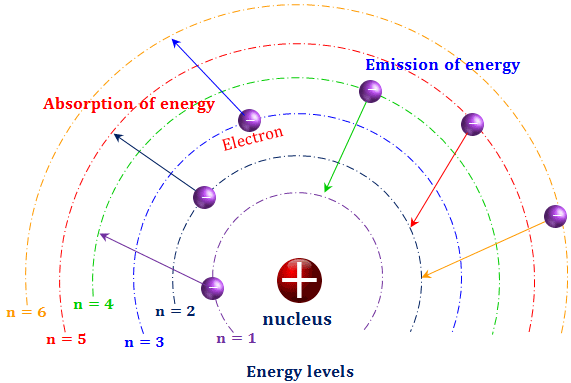
در ادامه این تحقیقات ذرات زیراتمی توسط رادرفورد و همکارانش کشف شدند. در سال 1911، رادرفورد مدل سیاره ای خود را از اتم ارائه داد كه در آن الكترون ها در مدارهای مختلف به دور هسته می چرخند، درست همانطور كه سیارات به دور خورشید می چرخند. با این حال، یک مشکل اساسی با این مدل وجود دارد. طبق نظریه الکترومغناطیسی کلاسیک، یک ذره باردار شتاب زده انرژی را به شکل نور منتشر می کند. یک الکترون که با سرعت ثابت روی هسته می چرخد در حال شتاب است زیرا جهت بردار سرعت آن بطور مداوم تغییر می کند. از این رو الکترون های موجود در مدل رادرفورد باید بطور مداوم با تابش، انرژی خود را از دست بدهند و پس از مدتی به سمت هسته سقوط کنند. بنابراین، طبق فیزیک کلاسیک مدل اتمی رادرفورد ناپایدار است.
نیلز بور در سال 1913 وقتی مفهوم کمی سازی انرژی را برای اتم هیدروژن به کار برد، راه حلی برای حل این مشکل ارائه کرد. بور فرض کرد که انرژی الکترون در یک اتم هیدروژن کوانتیزه است، و الکترون محدود است که فقط بر روی یکی از تعداد دایره های مجاز حرکت کند. هنگامی که یک الکترون از یک مدار بور به مدار دیگر انتقال می یابد، یک فوتون نوری با فرکانس ν تولید می شود:
E upper – E lower = hν
شواهد مربوط به طیف های اتمی، که فرکانس های گسسته را نشان می دهند، وجود مقدار انرژی معینی برای حرکت الکترون در مدارهای الکترونی را تایید می کند. در حالیکه مکانیک کلاسیک محدوده ای مداوم از انرژی را امکان پذیر می کند. اندازه گیری در حرکت موج اتفاق می افتد به عنوان مثال، فرکانس های اساسی و زیرین سیم ویولن. از این رو لوئیس دی بروگلی در سال 1923 پیشنهاد کرد که حرکت الکترون ها ممکن است جنبه موجی داشته باشند.
بررسی خاصیت دوگانه الکترون
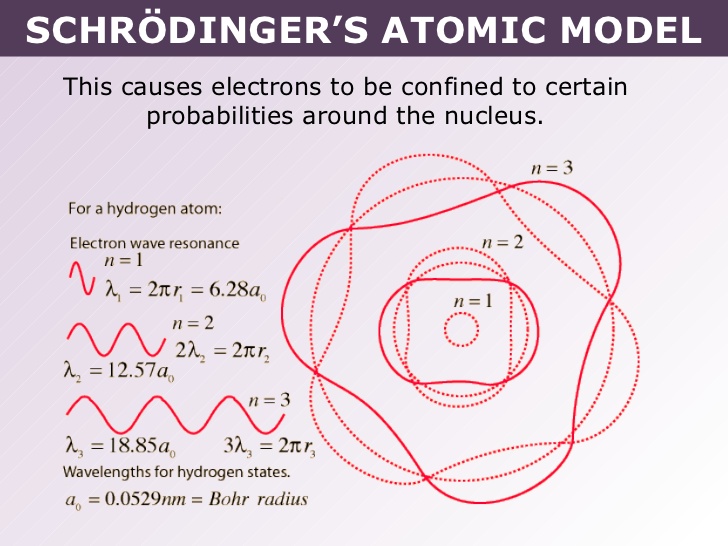
در سال 1925 دو دانشمند ورنر هایزنبرگ و اروین شرودینگر به طور جداگانه خاصیت دوگانه الکترون را به طور جداگانه مورد بررسی قرار دادند. نتایج تحقیقات این دو دانشمند نشان داد که الکترون ها همچون موج در اطراف هسته حرکت می کنند و به جای مدار در فضاهایی به نام اوربیتال قرار دارند.
در سال 1927 دیویسون و ژرمر با انعکاس الکترون ها از فلزات و مشاهده اثرات پراش، فرضیه دی بروگلی را به طور آزمایشی تأیید کردند. در سال 1932 استرن همان اثرات را با اتم های هلیوم و مولکول های هیدروژن مشاهده کرد، بنابراین تأیید کرد که اثرات موج برای الکترون ها خاص نیستند، بلکه از برخی از قانون های کلی حرکت برای ذرات ماکروسکوپی ناشی می شوند. بنابراین الکترون ها از بعضی جهات مانند ذرات و از جهات دیگر مانند امواج رفتار می کنند. ما با “دوگانگی موج-ذره” ماده به ظاهر متناقض روبرو هستیم.
حال سوال اینجاست که چطور ممکن است الکترون هم ذره ای باشد که مکان داشته باشد و هم موجی باشد که مکان نداشته باشد؟ پاسه این است که الکترون نه موج است و نه ذره! توصیف دقیق تصویری رفتار الکترون با استفاده از فیزیک کلاسیک غیرممکن است. مفاهیم فیزیک کلاسیک از تجربه در جهان ماکروسکوپی توسعه یافته اند و به درستی جهان میکروسکوپی را توصیف نمی کنند. تکامل مغز انسان را به گونه ای شکل داده است که به او امکان می دهد پدیده های ماکروسکوپی را بطور موثر درک کند و از عهده آن برآید. سیستم عصبی انسان برای مقابله با پدیده ها در سطح اتمی و مولکولی ایجاد نشده است، بنابراین تعجب آور نیست اگر نتوانیم چنین پدیده هایی را به طور کامل درک کنیم.
کاربرد کوانتوم در شاخه های شیمی
- در شیمی فیزیک از مکانیک کوانتومی برای محاسبه ویژگی های ترمودینامیکی گازها، تفسیر طیف های مولکولی، در نتیجه امکان تعیین ویژگی های مولکولی، محاسبه تئوری ویژگی های مولکولی، محاسبه ویژگی های حد واسط ها در واکنش های شیمیایی، تخمین ثابت سرعت واکنش ها، جهت درک نیروهای بین مولکولی و مبادله پیوند در جامدات استفاده می کنند.
- در شیمی آلی از مکانیک کوانتوم برای تخمین پایداری نسبی مولکول ها، جهت بررسی ویژگی های حداسط های واکنش، بررسی مکانیسم واکنش های شیمیایی و آنالیز و پیش بینی طیف رزوناس مغناطیسی هسته استفاده می کنند.
- در شیمی تجزیه از روش های گسترده ای برای اسپکتروسکوپی استفاده می شود. درک فرکانس ها و تنش های خطوط موجود در یک طیف را فقط از طریق کوانتوم امکان پذیر است.
- در شیمی معدنی از مکانیک کونتومی برای درک تئوری میدان لیگند، برای پیش بینی و توضیح ویژگی های کمپلکس های یونی فلزات واسطه استفاده می شود.
- بیوشیمیست ها از مطالعات مکانیک کوانتومی در مورد تغییر شکل مولکول های بیولوژیکی، اتصال آنزیم به بستر و حلالیت مولکول های بیولوژیکی بهره می برند.
- در نانوشیمی مکانیک کوانتومی خواص نانومواد را تعیین کرده و روش های محاسباتی برای مبادله با نانومواد را توسعه داده است. زمانیکه دو و یا تعداد بیشتری از ابعاد مواد کمتر از 100 نانومتر باشد، تغییرات چشمگیری در ویژگی های نوری، الکترونی، شیمیایی و دیگر خواص آن ها نسبت به حالت توده ای شان ایجاد می شود.
کاربرد شیمی کوانتوم در ساخت قطعات
- ترانزیستورها: در این قطعه پردازشگر اطلاعات، از خاصیت دوگانگی موجی-ذره ای الکترون به منظور قرار دادن فلز بین حالت رسانا و نارسانا استفاده می شود.
- جی پی اس: اساس کار جی پی اس بر مفاهیم کوانتوم قرار دارد.
- فلش مموری: استفاده از مفهوم تونل زنی کوانتومی که بر مبنای آن الکترون از لایه نارسانا عبور می کند. وقتی شما فلش خود را پاک می کنید از این خاصیت استفاده می کنید.
- میکروسکوپ: استفاده از این مفاهیم در ساخت میکروسکوپ های مخصوصی که به منظور مشاهده اتم ها ساخته شدند.
بیشتر بخوانید: سلول خورشیدی چیست؟چگونه پنل خورشیدی بسازیم؟
سوالات متداول
1- شیمی کوانتوم چیست؟
شیمی کوانتوم یک ابزار بسیار قدرتمند برای مطالعه خواص مولکول ها و واکنش آن ها است. این مبحث یکی از پویاترین زمینه های شیمی معاصر است که پایه ای محکم برای تمام زمینه های شیمی فراهم می کند. شیمی کوانتوم، مکانیک کوانتوم را در مسائل شیمی اعمال می کند و تاثیر آن در تمام شاخه های شیمی مشهود است.
2- چه تفاوتی بین شیمی کوانتوم و فیزیک کوانتوم وجود دارد؟
شیمی کوانتوم از مکانیک کوانتوم برای مدل سازی نحوه عملکرد اتم ها و مولکول ها در هنگام تعامل استفاده می کند. مطالعات فیزیک کوانتوم بیشتر مربوط به خود ذرات یا اتم ها است.
3- چهار عدد کوانتومی چیست؟
برای توصیف کامل الکترون در یک اتم، چهار عدد کوانتومی مورد نیاز است: انرژی (n)، حرکت زاویه ای (l)، گشتاور مغناطیسی (m) و چرخش (s). n عدد کوانتومی اصلی است و تراز انرژی را نشان می دهد. ℓ عدد کوانتومی برای نشان دادن زیرلایه ها و شکل و تعداد اوربیتال ها است و از صفر تا 3 می باشد. m عدد کوانتومی مغناطیسی بوده و جهت گیری اوربیتال ها در فضا را نشان می دهد. s عدد کوانتومی اسپین هسته است.
4- شیمی کوانتوم چه کاربردی دارد؟
شیمی کوانتوم تلاش می کند تا خصوصیات شیمیایی و فیزیکی مولکول ها و مواد را به دقت پیش بینی کند، که برای بسیاری از زمینه های علوم و مهندسی مفید است. پیش بینی خواص شیمیایی با استفاده از رویکرد اصول اولیه در مقیاس اتمی یک چالش نظری و محاسباتی است.








خیلی متن جامع و کاملیه واقعا ، ممنون